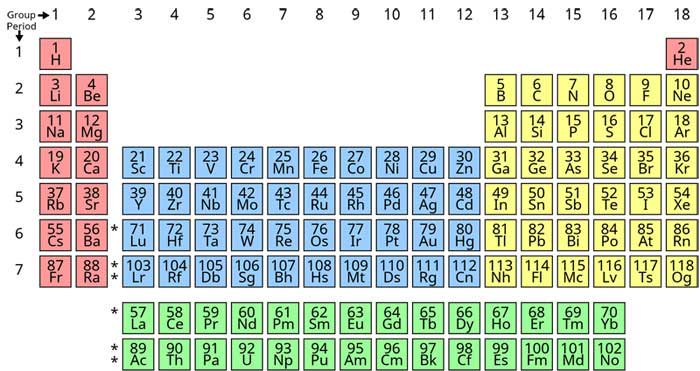
جدول تناوبی عنصرهای
شیمیایی یا جدول مَندَلیُف
(به انگلیسی:
Periodic table یا periodic table of elements)،
نمایش جدولی عنصرهای شیمیایی بر پایهٔ عدد اتمی، آرایش الکترونی و
ویژگیهای شیمیایی آنها است. ترتیب جایگیری عنصرها در این جدول از عدد
اتمی (شمار پروتونها) کمتر به سوی عدد اتمی بالاتر است. شکل استاندارد
این جدول ۱۸ × ۷
است؛ عنصرهای اصلی در بالا و دو ردیف کوچکتر از عنصرها در پایین جای
دارد. میتوان این جدول را به چهار مستطیل شکست، این چهار بلوک مستطیلی
عبارتند از: بلوک اس در سمت چپ، بلوک پی در راست، بلوک دی (فلزات
واسطه) در وسط و بلوک اف (فلزات واسطهٔ داخلی) در پایین. ردیفهای این
جدول، دوره و ستونهای آن، گروههای جدول تناوبی نام دارند. همچنین
گاهی برخی از این گروهها نامهای ویژهای دارند. برای نمونه گروه
هالوژنها و گازهای نجیب از آن جملهاند. هدف از ساخت جدول تناوبی، چه
به شکل مستطیلی و چه به شکلهای دیگر، بررسی بهتر ویژگیهای شیمیایی
عنصرها بودهاست. این جدول، کاربرد زیادی در دانش شیمی و پردازش رفتار
عنصرها دارد.
جدول تناوبی با نام دیمیتری مندلیف شناخته
شدهاست، با اینکه پیشروان دیگری پیش از او وجود داشتهاند. او این
جدول را در سال ۱۸۶۹ منتشر کرد. این، نخستین جدولی بود که به این
گستردگی مرتب شده بود. مندلیف این جدول را تهیه کرد تا ویژگیهای
دورهای آنچه که بعدها «عنصر» نام گرفت را بهتر نشان دهد. وی توانسته
بود برخی ویژگیهای عنصرهایی که هنوز کشف نشده بود را پیشبینی کند و
جای آنها را خالی گذاشته بود. کمکم با پیشرفت دانش، عنصرهای تازهای
شناسایی شد و جای خالی عنصرها در جدول پُر شد. با شناسایی عنصرهای نو و
گسترش شبیهسازیهای نظری دربارهٔ رفتار شیمیایی مواد، جدول آن روز
مندلیف بسیار گستردهتر شدهاست.
همهٔ عنصرهای شیمیایی از عدد اتمی ۱ (هیدروژن)
تا ۱۱۸ (اوگانسون) شناسایی یا ساخته شدهاند. دانشمندان هنوز به دنبال
ساخت عنصرهای پس از اوگانسون هستند و البته این پرسش را پیش رو دارند
که عنصرهای تازهتر چگونه جدول را اصلاح خواهند کرد. همچنین
ایزوتوپهای پرتوزای بسیاری هم در آزمایشگاه ساخته شدهاست. حجم مطالب
در مورد این جدول بسیار زیاد است ولی آنچه که مد نظر ماست همان 7 عدد
اصلی کوانتومی با نماد n است.
در جدول
تناوبی استاندارد عنصرها به ترتیب عدد اتمی (شمار پروتونها در هسته)،
به صورت صعودی مرتب شدهاند. هر ردیف تازه در جدول، که یک دوره یا
تناوب نامیده میشود، با افزوده شدن نخستین الکترون به یک لایهٔ
الکترونی تازه آغاز میشود. عنصرهایی که در یک ستون جدول (گروه) جای
گرفتهاند، همگی در لایهٔ آخر الکترونی خود دارای تعداد الکترونهای
برابر هستند؛ به عبارت دیگر آرایش الکترونی لایهٔ آخر آنها یکسان است.
مانند اکسیژن و سلنیم که هر دو در یک ستون هستند و هر دو چهار الکترون
در لایهٔ بیرونی آرایش الکترونی خود یعنی تراز p دارند. عنصرهایی که
ویژگیهای شیمیایی مشابه دارند، معمولاً در یک گروه از جدول قرار
میگیرند. اما در بلوک f عنصرهایی که در یک دوره هستند نیز ویژگیهای
مشابهی را نشان میدهند. در نتیجه به آسانی میتوان ویژگیهای شیمیایی
یک عنصر را با آگاهی از عنصرهای پیرامونیاش پیشبینی کرد.
یک گروه یا خانواده، یک ستون عمودی از
جدول تناوبی است. عنصرهای یک گروه معمولاً ویژگیهای نزدیک به هم
بیشتری نسبت به عنصرهای یک دوره یا بلوک دارند. دانش مکانیک کوانتوم که
دربارهٔ ساختار اتمی پژوهش میکند، نشان میدهد که چون عنصرهای موجود
در یک گروه همگی از آرایش الکترونی یکسانی در لایهٔ آخر الکترونی
برخوردارند؛ بنابراین ویژگیهای شیمیایی مشابهی از خود نشان میدهند و
هرچه عدد اتمی آنها بالاتر میرود، این مشابهتها افزایش پیدا میکند.
با این حال گاهی در بلوک d و f همانندیهای عنصرهای یک دوره به اندازهٔ
همانندیها در یک گروه مهم هستند. به همانندی (شباهت) در یک دوره،
همانندی افقی و در یک گروه، همانندی عمودی گفته میشود.
آرایش
الکترونی عنصرهای جدول، الگویی تکرار شونده دارند. الکترونها در هر
عنصر، مجموعهای از لایههای الکترونی را پُر میکند. هر لایهٔ
الکترونی از یک یا چند زیرلایه ساخته شدهاست که به آنها لایههای s و
p و d و f و g گفته میشود. هر چه عدد اتمی یک عنصر افزایش یابد،
لایهها و زیرلایههای الکترونی بیشتری در آن عنصر پُر میشود. این
لایهها بر پایهٔ اصل آفبا یا قانون تراز انرژی پر میشوند (همانند
نموداری که کشیده شدهاست). برای نمونه، آرایش الکترونی نئون با عدد
اتمی ۱۰ عبارت است از:
1s2 2s2 2p6
که دو الکترون در لایهٔ نخست و هشت الکترون در لایهٔ دوم (دو تا در
زیرلایهٔ s و شش تا در زیرلایهٔ p) جای میگیرد. برای نمونه، فلزهای
قلیایی و عنصر هیدروژن، همگی تنها یک الکترون در لایهٔ اس دارند.

ویژگیهای یک عنصر بیشتر به آرایش
الکترونی آن عنصر وابسته است. در نتیجه، چون آرایش الکترونی عنصرها در
جدول از نظم روشنی پیروی میکند، میتوان برخی رفتارهای فیزیکی و
شیمیایی عنصرها در جدول را پیشبینی کرد. پیش از آنکه نیلز بور نظریه
خود پیرامون آرایش الکترونی را مطرح کند، از روی این ویژگی پلهکانی
عنصرها، جای برخی از عنصرها در جدول پیشبینی شده بود.
به طور خلاصه کلیه عناصر موجود در
کیهان در رابطه با کلیه خواص فیزیکی و شیمیایی و ... از ریاضیات و
هندسه دوجینی ( 12 تایی) پیروی می کنند. یعنی همان شکل ابتدایی و ساده
زیر.
یعنی رابطه
ای بدیهی مابین هفت عدد اصلی کوانتومی ، هفت آسمان ها و هفت دوره تناوب
وجود دارد. و آن رابطه مربوط میشود به خود عدد 7.
محمدرضا طباطبايي 1401/2/22

